KUIS 3
Buatlah 2 soal per chapter dari chapter 1-12 kecuali chapter anda!
B. Tekanan dan momentum
C. Momentum dan gaya
D. Gaya dan impuls
E. Impuls dan momentum
- A. (26 , 26) : (88 , 88)
- B. (26 , 26) : (88 , 138)
- C. (26 , 30) : (88 , 138)
- D. (26 , 30) : (88 , 266)
- E. (26 , 56) : (88 , 138)
Pembahasan :
![]()
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
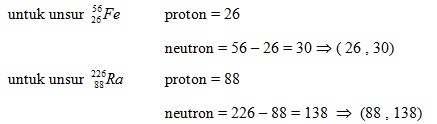
2. Diantara unsur – unsur ![]() yang terletak dalam golongan yang sama dalam sistem periodik adalah . . .
yang terletak dalam golongan yang sama dalam sistem periodik adalah . . .
- A. P dan Q
- B. Q dan S
- C. P dan R
- D. S dan T
- E. R dan T
- A. 22,4
- B.11,2
- C. 33,6
- D. 56
- E. 44,8
Pembahasan:
Pada kondisi STP (standar), volume molar gas O2 dirumuskan sebagai berikut.

Jadi, volume molar O2 pada kondisi STP adalah 44,8 L.
2. Diketahui massa atom relatif (Ar) dari H = 1, C = 12, O = 16. Tentukan persentase massa unsur C dalam senyawa glukosa (C6H12O6)!
- A. 10%
- B. 12%
- C. 24%
- D. 30%
- E. 40%
Pembahasan:
Pertama, Quipperian harus mencari massa molekul relatif (Mr) dari glukosa.

Tentukan persentase massa unsur C dalam glukosa.

Jadi, persentase massa unsur C di dalam glukosa adalah 40%.
- a. Meningkatkan [H+] bila dimasukkan kedalam H2O
- b. Menurunkan [H+] bila dimaasukkan kedalam H2O
- c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
- d. Menerima 1 H+ dari pasangan reaksinya
- e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
- Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
- Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
- a. 2 – log 4
- b. 2 + log 4
- c. 2 + log 2
- d. 12 + log 4
- e. 12
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
- A. 1,0028ATM
- B. 0.0036ATM
- C. 0,0028ATM
- D .0,0034ATM
- E. 0,0021ATM
Pembahasan:
Diketahui dari soal bahwa temperatur ruangan tidak berubah-ubah (konstan). Sehingga kita dapat menggunakan Hukum Boyle.
PV = k
P1V1 = P2V2
Maka besar P2 didapat sebesar:
2. Sebuah tangki selam mengandung udara dengan temperatur . Tangki selam berbentuk silinder dan memiliki volume sebesar . Berapa besar tekanan udara di dalam tangki tersebut.
(diketahui besar konstanta gas R = 8,3 J/mol . K)
- A. 10MPa
- B. 20MPa
- C. 30MPa
- D. 40MPa
- E. 50MPa
Pembahasan:
PV = nRT
P = 30 MPa
- a. Entalpi awal lebih besar daripada entalpi akhir dan ΔH > 0
- b. Entalpi awal lebih kecil daripada entalpi akhir dan ΔH > 0
- c. Entalpi awal lebih besar daripada entalpi akhir dan ΔH < 0
- d. Entalpi awal lebih kecil daripada entalpi akhir dan ΔH < 0
- e. Entalpi awal sama dengan entalpi akhir dan ΔH = 0
Pembahasan:
Reaksi endoterm adalah reaksi yang disertai dengan perpindahan kalor dari lingkungan ke sistem. Dalam reaksi reaksi ini, kalor diserap oleh sistem dari lingkungannya. Hal yang terjadi H akhir > H awal sehingga ΔH > 0 (berharga positif).
2. Dalam suatu calorimeter direaksikan 200 cm³ larutan NaOH 1 M dengan 200 cm³ larutan HCl 1 M, ternyata suhunya naik dari 29°C menjadi 36°C Kalor jensi larutan dianggap sama dengan kalor jenis air, yaitu 4,18 J/g°K dan massa jenis larutan dianggap 1 g/cm³.
Jika dianggap bahwa calorimeter tidak menyerap kalor, tentukanlah perubahan entalpi dari reaksi:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
- a. +50,16 kJ
- b. -50,16 kJ
- c. +80,14 kJ
- d. +11,704 kJ
- e. -11,704 kJ
Pembahasan:
qreaksi = -(qkalorimeter + qlarutan)
Oleh karena calorimeter tidak menyerap kalor, maka:
qreaksi = – qlarutan
volume = v NaOH + v HCl
= (200 + 200) mL
= 400 mL
massa larutan = volume larutan x rapatan larutan
= 400 mL x 1 gram/mL
= 400 gram
ΔT = (36 – 29 )°C
= 7°C
Atau ΔT = (36+273) – (29+273)
= 7 K
qlarutan = mlarutan x clarutan x ΔT
= 400 gram x 4,18 J/g K x 7 K
= 11.704 joule = 11,704 kJ
NaOH = HCl = 0,1L x 1 mol/L = 0,1 mol
Jadi pada reaksi antara 0,1 mol NaOH dengan 0,1 mol HCl terjadi perubahan kalor sebesar : qreaksi = – qlarutan
qreaksi = – 11,704 kJ
Maka, untuk setiap 1 mol NaOH yang bereaksi dengan 1 mol HCl akan terjadi perubahan kalor sebesar:
qreaksi = – 11,704 kJ/0,1 mol = – 11,704 kJ/mol
Perubahan kalor yang bertanda negative menunjukkan reaksi berlangsung secara eksoterm. Pada tekanan konstan, perubahan kalornya sama dengan perubahan entalpinya. Persamaan termokimianya:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l) ΔH= -11,704 kJ
1. Konfigurasi elektron unsur yang bernomor atom 23 adalah….
- A. 1s22s22p63s23p64s24p3
- B. 1s22s22p63s23p64s23d24p1
- C. 1s22s23s23p64s5
- D. 1s22s22p63s23p64s23d3
- E. 1s22s22p63s23p63d5
- A. S(16)
- B. Ni(28)
- C. Br(35)
- D. He(2)
- E. Ne(10)
- a. F
- b. Cl
- c. Br
- d. I
- 2. Urutan unsur-unsur periode ketiga dari arah kecil kebesar berdasarkan sifat ionisasinya adalah …
- a. Cl-P-Al-Na
- b. Na-Al-P-Cl
- c. Na-P-Al-Cl
- d. Cl-P-Al-Na
- e. P-Na-Cl-Al
pembahasan:
Kecenderungan energi ionisasi unsur-unsur periode ketiga dari kiri kekanan energi ionisasi cenderung bertambah. Berarti dari Na ke Ar energi ionisasinya cenderung bertambah . sehingga jwaban yang tepat dari pertanyaan di atas adalah Na-Al-P-Cl.
- a. N2 (nomor atom N = 7)
- b. O2 (nomor atom O = 8)
- c. H2 (nomor atom H = 1)
- d. H2O
- e. NH3
- a. H2O
- b. CH4
- c. CO2
- d. N2
- e. BH3
- dipol-dipol dan ion-dipol
- gaya dispersi, dipol-dipol, dan ion-dipol
- gaya dispersi, ikatan hidrogen, dipol-dipol, dan ion-dipol
- gaya dispersi dan dipol-dipol
- gaya dispersi, dipol-dipol, dan ikatan hidrogen
Gaya dispersi dimiliki oleh setiap zat yang berinteraksi. Demikian pula HI dengan H2S sudah pasti memiliki gaya dispersi. Ingat bahwa setiap spesi atau zat yang memiliki elektron akan memiliki gaya dispersi. Memang pengaruhnya biasanya kalah dibanding jenis interaksi lain bila ada bersamaan, namun tetap ada.
HI dan H2S merupakan molekul yang bersifat polar , pada molekul sesama polar maka terjadi interaksi dipol-dipol.
HI dan H2S tidak mungkin memiliki ikatan hidrogen, ikatan hidrogen hanya terjadi pada molekul yang punya ikatan H-F, H-O, H-N dan pada atom pusatnya harus memiliki PEB.
Kesimpulan jawaban yang tepat D.
- gaya dispersi London
- gaya dipol-dipol
- gaya ion-dipol
- ikatan hidrogen
- ikatan ion
Bentuk padat dari kebanyakan zat lebih rapat daripada fase cairnya, sebagian besar zat padat akan tenggelam dalam cairan. Berbeda dengan air, ini merupakan anomali air, es ini menyimpang dari karakter padatan pada umumnya. Zat yang memiliki kerapatan lebih rendah akan mengapung di permukaan zat cair yang memiliki kerapatan lebih besar.
Yang menyebabkan es memiliki kerapatan yang lebih rendah adalah adanya ikatan hidrogen pada molekul sebagai gaya antarmolekul air. Ikatan-ikatan hidrogen yang cukup kuat pada air padat ini membentuk kerangka tetrahedral sehingga meninggalkan rongga atau jarak. Dengan demikian ia memiliki kerapatan yang lebih kecil dibanding air dalam fase cair.
1. Hal – hal berikut merupakan sifat sistem koloid kecuali …
- a. Stabil
- b. Tidak dapat disaring
- c. ukuran partikel kurang dari 1 nm
- d. Homogen
- e. Menghamburkan cahaya
Pembahasan :
Ciri koloid :
- Homogen (secara makrokopis), heterogen (secara mikrokopis)
- Ukuran 1 nm – 100 nm
- Dua fase
- Stabil
- Tidak dapat disaring kecuali dengan penyaring ultra
- (1) Reaksi redoks
- (2) Busur bredig
- (3) Reaksi hidrolisis
- (4) Peptiasi
- (5) Reaksi pemindahan
- (6) Mekanik
Pembuatan koloid secara disperse adalah …
- a. 1, 2, dan 3
- b. 1, 3, dan 4
- c. 2, 3, dan 4
- d. 2, 4, dan 6
- e. 4, 5, dan 6
Pembahasan :
Cara dipersi ini merupakan dimana partikel kasar dipecah menjadi partikel koloid. Pembuatan koloid dengan cara disperse dapat dilakukan secara mekanik, peptiasi, atau dengan loncatan bunga listrik (cara busur bredig)



Tidak ada komentar:
Posting Komentar